توضیحات
فروش استات سدیم چگونه است ؟استات سدیم یکی از مهم ترین و پر کاربردترین مواد شیمیایی در جهان است که در صنایع مختلفی مورد استفاده قرار می گیرد. در این مقاله استات سدیم را کامل مورد بررسی قرار داده ایم. برای خرید استات سدیم و اطلاع از قیمت و فروش استات سدیم به صورت عمده و خرده ادامه مطلب را مطالعه بفرمایید.
شما مشتریان عزیز می توانید برای استعلام قیمت خرید با کارشناسان صنایع شیمیایی آراز تکین تماس حاصل فرمایید :
09120795991
استات سدیم چیست؟
استات سدیم یا اتانوات سدیم یک نمک سدیم است که از اسید استیک به دست میآید. استات سدیم ماده ای است که به راحتی می توان از سرکه و جوش شیرین تهیه کرد. با سرد شدن این مخلوط در زیر نقطه ذوب خود، متبلور می شود. کریستالیزاسیون یک فرآیند گرمازا است، بنابراین کریستال ها در واقع گرما تولید می کنند و نام رایج آن یعنی یخ داغ را به این ماده می دهند. این ترکیب مصارف صنعتی و خانگی متنوعی دارد.
در صنایع غذایی از اتانوات سدیم به عنوان نگهدارنده و ترشی استفاده می شود. از آنجایی که به غذا کمک می کند تا pH خاصی را حفظ کند، نمک می تواند از رشد باکتری های ناخواسته جلوگیری کند. در فرآیند ترشی کردن، از مواد شیمیایی به مقدار زیاد استفاده می شود، نه تنها برای محافظت غذا از میکروارگانیسم ها، بلکه برای افزایش طعم محصول غذایی.
به عنوان یک پاک کننده، استات سدیم با سطوح بالای اسید سولفوریک موجود در رواناب کارخانه مقابله می کند. با از بین بردن زنگ زدگی و لکه ها، سطوح فلزی براق را حفظ می کند. همچنین می توان آن را در محلول های برنزه کننده چرم و درمان های رشد عکاسی یافت.
استات سدیم نیز در صنعت سلامت نقش دارد. رقیق، می توان آن را به عنوان یک محلول نمک جایگزین برای کلرید سدیم در IV استفاده کرد. در حالی که خطرات استفاده از استات سدیم نسبتاً کم است، اما ارزش دانستن دارد. استات سدیم باید قبل از افزودن به IV رقیق شود.
بیمار باید محلول را به آرامی دریافت کند تا از احتباس آب و عدم تعادل الکترولیت جلوگیری شود. برای بیماران مبتلا به مشکلات کلیوی، آلومینیوم موجود در این محلول می تواند سمی باشد. با وجود این خطرات، راه حل برای همه بیماران ایمن تلقی شده است.
بسیاری از افراد ممکن است بدون اینکه بدانند نوعی استات سدیم در خانه خود داشته باشند، زیرا این ترکیب اغلب در پدهای گرمایشی استفاده می شود. بسیار اشباع شده در آب، به شکل مایع باقی می ماند تا زمانی که دیسک فلزی معلق در محلول خم شده و خم شود.
این کار به راحتی با کار کردن پد با دست انجام می شود. به دیسک فلزی چند مولکول متبلور متصل شده اند که با حرکت دیسک آزاد می شوند.
آنها یک واکنش زنجیره ای تسریع شده با مولکول های دیگر در محلول ایجاد می کنند که به سرعت جامد می شوند و گرما منتشر می کنند. گرما می تواند درد و درد را در هنگام درد عضلانی کاهش دهد. بسته کوچک را می توان به عنوان گرم کننده جیبی در زمستان استفاده کرد. این بسته ها زمانی قابل استفاده مجدد می شوند که بسته ها در آب جوش غوطه ور شوند و به آرامی به دمای اتاق برگردند.
استات سدیم ، همچنین به عنوان اتانوات سدیم (به اختصار NaOAc) شناخته می شود، نمک سدیم اسید استیک است. فرمول شیمیایی آن CH 3 COONa است و بین یون سدیم و یون استات پیوند یونی وجود دارد.
این ترکیب شیمیایی به طور طبیعی در بافت های گیاهی و جانوری وجود دارد. می توان آن را به هر شکلی یافت، بی آب یا تری هیدراته. هر دو یون Na + و CH 3 CoO – در ارگانیسم ها وجود دارند و عملکردهای مهمی را انجام می دهند: یون های سدیم به عنوان تنظیم کننده کل آب بدن و یون های استات به عنوان گیرنده های هیدروژن
استات سدیم ترکیبی است که می توان آن را به روشی ساده و در دسترس برای همه تهیه کرد. تهیه آن معمولاً به عنوان “آزمایش یخ داغ” نامیده می شود، زیرا تبلور شبیه آب در حالت جامد است
برای تهیه استات سدیم تنها به سرکه (اسید استیک) و کربنات سدیم یا بی کربنات سدیم نیاز دارید. به سادگی افزودن بی کربنات به سرکه یک واکنش واکنشی ایجاد می کند زیرا مطابق واکنش ها دی اکسید کربن آزاد می کند.
CH 3 KOH + NHO 3 → CH3COONa + H 2 CO 3
H 2 CO 3 → CO 2 + H 2 O
کربنات یا بی کربنات سدیم را می توان با هیدروکسید سدیم (آلیزه) جایگزین کرد، جایی که استات سدیم و آب مطابق با واکنش تولید می شوند:
CH 3 COOH + NaOH → CH3COONa + H 2 O
این واکنش باعث کونژوگاسیون نمی شود، اگرچه این عیب را دارد که مدیریت هیدروکسید سدیم نسبت به بی کربنات دشوارتر است.
برای دستیابی به اثر تبلور (یا اثر یخ داغ) محلول باید با حرارت دادن آن فوق اشباع شود تا بی کربنات تا حد ممکن حل شود. سپس ظرف درپوش سرد شده و سپس تبلور مجدد می شود. پس از آن، کریستال ها فیلتر شده و برای ذخیره سازی پودر می شوند .

خواص فیزیکی و شیمیایی
استات سدیم یک لیوان سفید رطوبت با بوی سرکه است.
در مورد فرم بی آب این ترکیب، وزن مولکولی 03/82 گرم بر مول و چگالی آن 5/1 گرم بر میلی لیتر است. نقطه ذوب آن 324 درجه سانتی گراد و نقطه جوش آن 881.4 درجه سانتی گراد است.
ظرفیتی خود دارای وزن مولکولی 03/136 گرم بر مول و چگالی آن 45/1 گرم بر میلی لیتر است. نقطه ذوب و نقطه جوش به ترتیب به 58 درجه سانتیگراد و 122 درجه سانتیگراد کاهش می یابد.
استات سدیم در آب بسیار محلول است. حلالیت فرم تری هیدرات 46.5 گرم استات سدیم در 100 میلی لیتر آب در دمای 20 درجه سانتیگراد است و به شکل بی آب آن می تواند 123 گرم در هر 100 میلی لیتر آب را حل کند
در استون، متانول، هیدرازین و شکل تری هیدرات محلول در اتانول هستند. استات سدیم دارای ساختار کریستالی مونوکلینیک است
استات سدیم پایه مزدوج اسید استیک است، بنابراین می توانید از محلول اسید استیک/استات سدیم برای تهیه یک محلول بافر برای کنترل pH استفاده کنید.
محلول استات سدیم در آب قلیایی ضعیف است. هنگامی که حرارت از 324 درجه سانتیگراد فراتر رود، این نمک تجزیه می شود و بخار اسید استیک تولید می کند.

پاسخ و تهدید
استات سدیم به عنوان یک ترکیب پایدار طبقه بندی می شود و با عوامل اکسید کننده ناسازگار است. هنگامی که گرم می شود می تواند بخار اسید استیک تولید کند و CO 2 آزاد کند. این ترکیب می تواند در دمای بالا قابل احتراق باشد و CO و CO 2 آزاد می کند.
ایمنی استات سدیم به طور گسترده در مدلهای حیوانی موشها و موشها مورد مطالعه قرار گرفته است. هنگامی که به صورت خوراکی تجویز می شود، دوز کشنده ای که نیمی از جمعیت موش ها را می کشد، 3530 میلی گرم استات سدیم به ازای هر وزن بدن موش است.
در صورت استنشاق به جای بلع، دوز مورد نیاز برای کشتن نیمی از جمعیت موش بسیار بالاست، بیش از 30 گرم بر متر مکعب در ساعت.
در موشها، تزریق زیر جلدی یا زیر جلدی 3200 میلیگرم بر کیلوگرم وزن بدن، نیمی از جمعیت موشها را میکشد، مشابه مصرف استات سدیم در موشها.
اگرچه در موشها وقتی خوراکی داده میشود، میتوانند بسیار بیشتر از موشها مقاومت کنند. 6891 میلی گرم بر کیلوگرم وزن بدن دوز کشنده برای نیمی از جمعیت موش است.
در انسان، استنشاق استات سدیم می تواند باعث سرفه و گلودرد شود، در حالی که تماس مستقیم با پوست یا چشم می تواند باعث قرمزی و سوزش شود. با این حال، و به طور کلی، سمیت در انسان حداقل است .
می تواند باعث تحریک دستگاه گوارش همراه با درد شکم، حالت تهوع، استفراغ شود و بر سیستم ادراری تأثیر بگذارد. استنشاق این ترکیب ممکن است باعث تحریک دستگاه تنفسی شود. علائم ممکن است شامل سرفه، گلودرد، تنگی نفس و درد قفسه سینه باشد.
در صورت تماس با چشم، لنزهای تماسی باید بررسی و دور انداخته شوند. چشم ها را باید فوراً با آب فراوان به مدت حداقل 15 دقیقه شست. می توانید از آب سرد استفاده کنید. در صورت بروز تحریک باید به دنبال مراقبت پزشکی بود.
در صورت تماس با پوست باید با آب و صابون شسته شود. می توانید از آب سرد استفاده کنید. پوست تحریک شده با یک نرم کننده پوشیده شده است. با تماس با چشم، در صورت ایجاد تحریک باید مراقبت های پزشکی انجام شود.
در صورت استنشاق، قربانی باید به مکان خنک منتقل شود. در صورت عدم تنفس، باید تنفس مصنوعی داده شود. اگر تنفس دشوار است، باید اکسیژن تامین شود. یک بار دیگر، ضروری است که فورا مراقبت های پزشکی را دریافت کنید.
در صورت بلع، استفراغ نباید ایجاد شود، مگر اینکه پرسنل پزشکی به وضوح نشان دهند. هرگز چیزی را از طریق دهان به فرد بیهوش ندهید.
لباس های گشاد مانند یقه پیراهن، کراوات یا کمربند باید گشاد شوند. در صورت بروز علائم باید به دنبال مراقبت های پزشکی بود
حمل و نقل و انبار
– ترکیب باید دور از منابع حرارتی و اشتعال نگهداری شود
ظروف خالی خطر آتش سوزی هستند و باقیمانده های تبخیر شده در زیر هود استخراج می شوند.
برای جلوگیری از جرقه، تجهیزات الکتریکی باید بر روی زمین قرار گیرد
-از قورت دادن یا تنفس گرد و غبار خودداری کنید
– پوشیدن لباس محافظ مناسب
-در صورت عدم تهویه باید از دستگاه تنفسی کافی استفاده شود
-در صورت بلع بلافاصله به پزشک مراجعه و ظرف یا برچسب آن را نشان دهید
– معرف باید دور از مواد ناسازگار مانند عوامل اکسید کننده و اسیدها نگهداری شود.
در ظرف را محکم بسته نگه دارید، مگر در مکانی خنک و دارای تهویه مناسب.

موارد استفاده و کاربردها
استات سدیم در طیف بسیار متنوعی از صنایع استفاده می شود. در صنعت نساجی، استات سدیم جریان های زائد اسید سولفوریک و همچنین رنگ آبی را خنثی می کند. این باعث بهبود کیفیت لباس های تمام شده می شود.
استات سدیم بخشی از محلول توسعه دهنده است و به عنوان یک مقاومت نوری عمل می کند. استات سدیم برای کاهش آسیب های ناشی از آب به بتن با عمل به عنوان یک درزگیر استفاده می شود، در حالی که برای محیط زیست بی خطر است و معمولاً اپوکسی برای آب بندی بتن در برابر نفوذ آب استفاده می شود. ارزان تر از جایگزین ها.
همچنین یک عامل ترشی در دباغی کروم است و به جلوگیری از ولکانیزه شدن کلروپرن در تولید لاستیک مصنوعی کمک می کند. در پردازش پنبه برای پدهای پنبه ای یکبار مصرف، از استات سدیم برای از بین بردن تجمع الکتریسیته ساکن استفاده می شود.
در غذا، استات سدیم به عنوان یک نگهدارنده و یک عامل طعم دهنده عمل می کند. به طور خاص، چیپس سیب زمینی حاوی استات سدیم دارای طعم متمایز “نمک و سرکه” است.
استات سدیم همچنین در پدهای گرمایشی، دست گرمکن و یخ داغ استفاده می شود. بلورهای استات سدیم تری هیدرات در دمای 58.4 درجه سانتی گراد ذوب می شوند و تبلور آنها در آب حل می شود.
هنگامی که فراتر از نقطه ذوب حرارت داده می شود و متعاقباً اجازه داده می شود تا خنک شود، محلول آبی فوق اشباع می شود. این محلول قادر است تا دمای اتاق بدون تشکیل کریستال خنک شود.
با فشار دادن یک دیسک فلزی در پد حرارتی، یک مرکز هسته تشکیل می شود که منجر به تبلور مجدد به تری هیدرات استات سدیم جامد می شود. فرآیند تشکیل پیوند کریستالیزاسیون گرمازا است. گرمای نهان همجوشی حدود 264-289 کیلوژول بر کیلوگرم است.
بر خلاف برخی از انواع بستههای حرارتی، مانند بستههایی که به واکنشهای شیمیایی برگشتناپذیر متکی هستند، بسته حرارتی استات سدیم را میتوان به راحتی با فرو بردن بسته در آب در حال جوش برای چند دقیقه، تا زمانی که کریستالها کاملاً حل شوند، دوباره استفاده کرد. اجازه دهید بسته به آرامی خنک شود تا زمانی که به دمای اتاق برسد.
محلول استات سدیم و اسید استیک به عنوان یک بافر برای حفظ pH نسبتاً پایدار عمل می کند، این خاصیت مفید برای واکنش های تحقیقاتی بیوشیمیایی و همچنین صنعت نفت و صنایع آرایشی و بهداشتی است.
استات سدیم می تواند برای رسوب اسیدهای نوکلئیک کوچک استفاده شود. این رسوب میتواند برای تغلیظ اسیدهای نوکلئیک کوچک از محلولهای رقیق، مانند بافر کار پایینتر پس از شکنش FlashPAGE استفاده شود.
هنگامی که کمتر از 2 میکروگرم اسید نوکلئیک در یک خردکن FlashPAGE بارگذاری می شود، رسوب با استات سدیم/اتانول در طول شب با وسیله ای مانند آکریل آمید خطی یا گلیکوژن همراه با بافر برای به حداکثر رساندن بازیابی اسیدهای نوکلئیک توصیه می شود. آهسته. تدریجی.
استفاده از گلیکوژن به عنوان یک حامل برای نمونه های مورد استفاده برای تجزیه و تحلیل تراشه های DNA (باران استات سدیم از اسیدهای نوکلئیک کوچک، SF) توصیه نمی شود.
در پزشکی، محلول های استات سدیم برای درمان بیمارانی که سطح اسید خون بالا و/یا سطوح سدیم پایین دارند استفاده می شود.
سدیم کاتیون اصلی مایع خارج سلولی است. بیش از 90٪ از کل کاتیون ها را در غلظت طبیعی پلاسما تقریبا 140 میلی اکی والان در لیتر تشکیل می دهد. یون سدیم نقش مهمی در کنترل کل آب بدن و توزیع آن ایفا می کند .
استات یک گیرنده یون هیدروژن است. همچنین به عنوان منبع جایگزین بی کربنات (HCO3-) برای تبدیل متابولیک در کبد عمل می کند. نشان داده شده است که این تبدیل حتی در صورت وجود بیماری شدید کبدی به آرامی انجام می شود.
تزریق استات سدیم رقیق شده در آب به عنوان یک الکترولیت تکمیل می شود. هر 20 میلی لیتر حاوی 3.28 گرم استات سدیم است که 40 میلی اکی والان سدیم (Na +) و استات (HCO 3 – ) را فراهم می کند. محلول حاوی باکتریوستات، عامل ضد میکروبی یا بافر اضافه شده نیست. ممکن است حاوی اسید استیک برای تنظیم pH باشد (pH 6.5 (6.0 تا 7.0)). غلظت اسمزی 4 mOsmol/ml (کالک) است.
این محلول به عنوان جایگزینی برای کلرید سدیم برای تامین یون های سدیم (Na+) علاوه بر مایعات تزریقی با حجم بالا برای استفاده داخل وریدی در نظر گرفته می شود
محلول های حاوی یون های سدیم باید با احتیاط فراوان استفاده شوند، به ویژه در بیماران مبتلا به نارسایی احتقانی قلب، نارسایی شدید کلیه و شرایط بالینی که در آن ادم با احتباس سدیم همراه است.
در بیماران مبتلا به اختلال عملکرد کلیه، محلول های حاوی یون سدیم ممکن است منجر به احتباس سدیم شود. محلول های حاوی یون استات باید در بیماران مبتلا به آلکالوز متابولیک یا تنفسی با احتیاط فراوان استفاده شوند.
استات باید با احتیاط زیاد در شرایطی که سطح این یون افزایش می یابد یا استفاده از آن مختل می شود، مانند نارسایی شدید کبدی، تجویز شود.
استات سدیم نمک سدیم اسید استیک است که فرمول مولکولی آن C 2 H 3 یا 2 Na است و از یک پودر سفید ظریف تشکیل شده است که عمدتاً به دو شکل بی آب و تری هیدرات وجود دارد. هر دو بسیار محلول در آب، یک حلال جهانی هستند. اما در الکل یا استون چندان محلول نیست.
فرم بی آب دارای چگالی، نقطه ذوب و نقطه جوش بالاتری نسبت به فرم تری هیدرات استات سدیم است. این به این دلیل است که مولکول های آب بین فعل و انفعالات یون های Na تداخل می کنند. + و CH 3 خنک –
استات سدیم پایدار است، به خصوص زمانی که در دمای 2 تا 8 درجه سانتی گراد نگهداری شود. اما به عوامل اکسید کننده قوی و هالوژن حساس است.
می توان آن را با واکنش بی کربنات سدیم با اسید استیک تهیه کرد. همچنین با واکنش اسید استیک با هیدروکسید سدیم. هر دو واکنش ساده و ارزان هستند. اولین مورد را می توان در خانه انجام داد.
این نمک یک ترکیب کم سمی است. تنها پس از تماس مکرر و مداوم باعث تحریک پوست می شود. برای چشم ها کمی تحریک کننده است اما ممکن است دستگاه تنفسی را تحریک کند. اطلاعاتی در مورد اثرات مضر آن وجود ندارد.
کاربردها و کاربردهای زیادی دارد و عملکرد بافر pH آن را به همراه اسید استیک برجسته می کند. بافر استات دارای pKa = 4.7 است. که کارایی بالایی در تنظیم pH در محیط های اسیدی با مقادیر pH از 3 تا 6 فراهم می کند.
به دلیل سمیت و خواص کم، به طور گسترده ای برای بهبود طعم غذا استفاده می شود و همچنین عاملی است که به دلیل عملکرد در برابر میکروب ها، در برابر فساد مواد غذایی محافظت می کند.
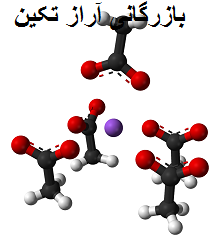
کریستال های استات سدیم بی آب (بدون آب) را تشکیل می دهند. کره ارغوانی مربوط به کاتیون Na + و یون مولکولی سمت چپ آن استات، CH3 Cool – است که اتمهای اکسیژن آن با کرههای قرمز نشان داده میشوند.
این جفت ها، طبق فرمول CH 3 COONa، به نسبت 1: 1 هستند. برای هر آنیون CH 3 سرد – باید یک کاتیون Na + جذب بار منفی آن باشد و بالعکس. بنابراین، جاذبههای بین آنها و دافعههای بین بارهای مساوی منجر به ایجاد الگوهای ساختاری میشوند که کریستال را تعریف میکنند، که حداقل بیان آن سلول واحد است.
سلول واحد مذکور، مانند کریستال به عنوان یک کل، با توجه به آرایش یون ها در فضا متفاوت است. این همیشه یکسان نیست، حتی برای یک سیستم کریستالی. به عنوان مثال، استات سدیم بی آب می تواند دو پلی مورف ارتورومبیک را تشکیل دهد که یکی از آنها در زیر نشان داده شده است:
به ترتیب یونها توجه کنید: چهار یون CH 3 سرد میشوند – Na + را قفل میکنند تا یک هرم با قاعده مربعی منحرف شده را “رسم کنند”. هر یک از این ch 3 خنک – به نوبه خود آنها با دیگر Na + مجاور تعامل.
کریستال های هیدراته
استات سدیم میل ترکیبی بالایی برای آب دارد. در واقع رقیق است یعنی تا زمانی که در آن حل شود رطوبت را حفظ می کند. هر چه رطوبت بیشتر باشد، سریعتر “ذوب می شود”. این به این دلیل است که هر دو CH 3 خنک می شوند – همانطور که Na + می تواند هیدراته کند، مولکول های آب را احاطه می کند که دوقطبی های خود را به سمت بارهای خود هدایت می کنند (Na + OH 2 , CH 3 cool – HOH).
هنگامی که این نمک در آزمایشگاه یا در خانه تهیه می شود، رابطه آن با آب به گونه ای است که حتی در دمای معمولی از قبل به عنوان یک هیدرات به دست می آید. CH 3 COONa 3H 2 O. کریستالهای آنها از حالت اورتورومبیک خارج میشوند و تبدیل به مونوکلینیک میشوند، زیرا اکنون آنها شامل سه مولکول آب برای هر جفت CH 3 سرد – و Na + هستند.
نام های دیگر
– استات سدیم
-اتانوات سدیم (IUPAC).
جرم مولی
– هیدروژن: 82.03 گرم در مول.
– تری هیدرات: 136.03 گرم در مول.
ظاهر
پودر سفید لذیذ
بو
به سرکه در هنگام تجزیه گرم شود.
تراکم
– هیدروژن: 1.528 گرم بر سانتی متر مکعب در 20 درجه سانتی گراد
تری هیدرات: 1.45 گرم بر سانتی متر 3 در 20 درجه سانتی گراد
نقطه ذوب
– بی آب: 324 درجه سانتی گراد (615 درجه فارنهایت، 597 کلوین).
تری هیدرات: 58 درجه سانتی گراد (136 درجه فارنهایت، 331 کلوین).
نکته کلیدی
– بی آب: 881.4 درجه سانتیگراد (1618.5 درجه فارنهایت، 1154.5 K).
تری هیدرات: 122 درجه سانتی گراد (252 درجه فارنهایت، 395 کلوین). خراب می شود
انحلال پذیری
در کشور
– بی آب: 123.3 گرم / 100 میلی لیتر در 20 درجه سانتیگراد.
– تری هیدرات: 46.4 گرم / 100 میلی لیتر در 20 درجه سانتیگراد.
در متانول
16 گرم / 100 گرم در 15 درجه سانتیگراد
در اتانول
5.3 گرم / 100 میلی لیتر (تری هیدرات).
در استون
0.5 گرم بر کیلوگرم در دمای 15 درجه سانتیگراد
اسیدیته
pKa: 24 (20 درجه سانتیگراد).
پایه ای
pKb: 9.25. در اینجا واضح است که استات سدیم نمک پایه است زیرا pKb آن کمتر از pKa است.
ضریب شکست (ηD)
1,464
ارزش حرارتی
-100.83 J / mol • K (بی آب).
-229.9 J / mol • K (تری هیدرات).
نقطه اشتعال
بالای 250 درجه سانتیگراد
دمای احتراق خودکار
600 درجه سانتیگراد
pH
8.9 (محلول 0.1 مولار در 25 درجه سانتیگراد).
ثبات
پایدار. ناسازگار با عوامل اکسید کننده قوی و هالوژن ها. به رطوبت حساس است.
واکنش ها
استات سدیم می تواند با واکنش با یک آلکیل هالید یک استر تشکیل دهد. به عنوان مثال، برومتان:
CH 3 COONa + BrCH 2 CH 3 => CH 3 COOCH 2 CH 3 + NaBr
استات سدیم در حضور NaOH به متان تبدیل می شود (تجزیه کننده گاز):
CH 3 COONa + NaOH => CH 4 + Na 2 شرکت 3
این واکنش توسط نمک های سزیم کاتالیز می شود.
سنتز
استات سدیم را می توان با واکنش بی کربنات سدیم با اسید استیک به صورت ارزان در آزمایشگاه تولید کرد:
NaHCO 3 + CH 3 COOH => CH 3 COONa + H 2 شرکت 3
این واکنش با وجود حباب شدید در محلول، به دلیل تجزیه اسید کربنیک به آب و دی اکسید کربن همراه است.
H 2 Company 3 => H 2 O + CO 2
در صنعت، استات سدیم از واکنش اسید استیک با هیدروکسید سدیم تولید می شود.
CH 3 COOH + NaOH => CH 3 COONa + H 2
کاربرد ها
کیسه های حرارتی
از استات سدیم برای ساخت کیسه های حرارتی استفاده می شود.
ابتدا کریستال های نمک را در حجمی از آب حل می کنند تا محلولی که فوق اشباع می شود تهیه شود.
سپس محلول تا دمای بالاتر از 58 درجه سانتیگراد که نقطه ذوب آن است گرم می شود. محلول فوق اشباع به دمای اتاق خنک شد و هیچ کریستالی مشاهده نشد. محلول فوق خنک است.
عدم وجود کریستال ها با این واقعیت توضیح داده می شود که مولکول های مایع بیش از حد بی نظم هستند و جهت گیری مناسب برای رسیدن به دمای تبلور را ندارند. مایع در حالت فراپایدار و در حالت عدم تعادل است.
با توجه به ناپایداری مایع فوق سرد، هرگونه اختلال برای شروع کریستالیزاسیون کافی است. در مورد کیسه های حرارتی، اتصال مکانیکی فشار داده می شود تا مایع را به هم بزند و تشکیل کریستال ها و انجماد محلول تری هیدرات استات سدیم را آغاز کند.
تبلور رخ می دهد، دما افزایش می یابد. کریستال های تری هیدرات استات سدیم ظاهر یخ به خود می گیرند، اما داغ هستند، به همین دلیل به آن “یخ داغ” می گویند.
صنعتی
-استات سدیم در صنعت نساجی به عنوان فرآیند رنگرزی پارچه استفاده می شود
– بقایای اسید سولفوریک را خنثی می کند
– در فرآوری پنبه برای تولید پدهای پنبه ای مورد استفاده در بهداشت شخصی و برای اهداف پزشکی استفاده می شود.
– در ترشی فلزات قبل از آبکاری کروم استفاده می شود
– همکاری برای اینکه کلروپرن در فرآیند تولید لاستیک مصنوعی ولکانیزه نشود.
– در پاکسازی گلوکز شرکت می کند
-در دباغی چرم استفاده می شود.
استفاده پزشکی
استات سدیم یکی از ترکیباتی است که برای دادن الکترولیت به بیماران به صورت داخل وریدی استفاده می شود.
برای اصلاح سطح سدیم در بیماران هیپوناترمیک و همچنین برای اصلاح اسیدوز متابولیک و قلیایی شدن ادرار استفاده می شود.
محلول بافر PH
این ماده به عنوان تنظیم کننده pH در بسیاری از واکنش های آنزیمی که بین pH 3 و 6 رخ می دهد استفاده می شود.
pH متفاوت محلول بافر استات با تغییر غلظت اسید استیک و استات سدیم به دست می آید.
بنابراین، به عنوان مثال، برای به دست آوردن pH 4.5، محلول بافر دارای غلظت اسید استیک 3.8 گرم در لیتر و غلظت استات سدیم بی آب 3.0 گرم در لیتر است.
غلظت بافر استات را می توان افزایش داد و اجزای محلول لازم برای به دست آوردن pH مورد نظر را به همان نسبت افزایش داد.
بافر استات/استونیتریل در الکتروفورز مویرگی برای جداسازی فتوبربرین ها استفاده می شود.
آزمایشگاه های تحقیقاتی
-استات سدیم یک عامل هسته دوست ضعیف است که در پلیمریزاسیون آنیونی β-لاکتون استفاده می شود.
– به عنوان یک معرف در هنگام تشدید مغناطیسی هسته ای ماکرومولکول های بیولوژیکی استفاده می شود.
– به استخراج DNA از سلول ها کمک می کند. سدیم کاتیونی است که با بارهای منفی فسفات ها در DNA برهمکنش می کند و به متراکم شدن آنها کمک می کند. در حضور اتانول، DNA رسوبی را تشکیل می دهد که سپس می تواند به آب جدا شود.
نگهداری مواد غذایی
-به جلوگیری از رشد باکتری ها کمک می کند، علاوه بر آن از اسیدیته اضافی که باعث فساد غذا می شود جلوگیری می کند و در نتیجه pH خاصی را حفظ می کند.
– سدیم موجود در استات باعث افزایش طعم غذا می شود.
-از استات سدیم برای تهیه ترشی سبزیجات خیار، هویج، پیاز و … استفاده می شود. علاوه بر این، در نگهداری گوشت نیز استفاده می شود.
حفاظت از بتن
بتن در اثر عمل آب آسیب می بیند که باعث کاهش عمر آن می شود. استات سدیم به عنوان یک درزگیر بتن عمل می کند و آن را ضد آب می کند و خواص اصلی آن را طولانی می کند.
سمیت
استات سدیم یک ترکیب با سمیت بسیار کم است. همچنین به عنوان یک حساس کننده پوست یا دستگاه تنفسی طبقه بندی نمی شود.
علاوه بر این، استات سدیم به عنوان جهشزا، سرطانزا یا سم تولید مثلی در سلولهای زایایی طبقهبندی نمیشود.
خلاصه کمی چشم را اذیت می کند. ممکن است پس از استنشاق، تحریک دستگاه تنفسی رخ دهد. تماس مکرر و مداوم با پوست ممکن است باعث تحریک شود.
خرید استات سدیم
شما مشتریان عزیز می توانید برای خرید استات سدیم مرغوب و با اصالت کیفیت و با ارائه فاکتور رسمی و غیر رسمی با کاشناسان ما در ارتباط باشید و همچنین برای دیدن نمونه محصولات بیشتر این شرکت مانند سولفات اهن پودری کلیک نمایید .
09120795991










نقد و بررسیها
هیچ دیدگاهی برای این محصول نوشته نشده است.